DEPORTE Y PROTIDES en colaboración con ATLET
Resumen'
Las proteínas constituyen una familia química heterogénea y se consideran biomoléculas de primera importancia:
Cuantitativamente, las proteínas representan del 55 al 85% del peso seco. Son el segundo elemento más común en el cuerpo después del agua.
Cualitativamente, tienen un papel estructural pero también un papel funcional vital.
Salvo casos excepcionales (ayunos prolongados, reservas insuficientes de glucógeno, etc.), las proteínas no contribuyen de forma significativa a cubrir las necesidades energéticas.
Nuestras necesidades son muy importantes en términos de proteínas. ¡Nuestra organización fabrica casi 100 tipos diferentes!
Todas las proteínas se construyen a partir de 20 aminoácidos diferentes.
Entre ellos, 8 son aminoácidos esenciales (EAA): el cuerpo humano no sabe cómo fabricarlos. La comida, por lo tanto, debe proporcionarlos y, lo que es más, en la misma comida. Porque, si para producir una de sus proteínas, al cuerpo le falta sólo uno de estos 8 EAA, la producción de la proteína se detiene, no sabiendo el cuerpo apartar los otros 7 hasta que llega el 8.
Las proteínas animales aportan todos estos 8 EAA, lo que no ocurre con las proteínas vegetales, que son deficientes en uno de los 8 EAA. Por lo tanto, los vegetarianos deben comer en la misma comida tanto cereales (trigo, maíz, arroz, etc.) bajos en lisina como legumbres (lentejas, garbanzos, etc.) bajas en metionina.
La síntesis de proteínas es esencial para el desarrollo, el crecimiento, pero también para mantener la masa corporal. Si los carbohidratos representan la fuente esencial de suministro de energía, el ejercicio regular aumenta significativamente los requerimientos diarios de compuestos nitrogenados. En condiciones muy específicas, es probable que ciertos aminoácidos se oxiden para constituir sustratos energéticos por derecho propio. Sin embargo, todas las proteínas presentes en el cuerpo juegan un papel funcional específico y no hay aminoácidos almacenados y almacenados como carbohidratos o lípidos. Si es necesario, por lo tanto, son los aminoácidos derivados de proteínas estructurales o funcionales los que se utilizarán, lo que probablemente afecte el funcionamiento del organismo.
Entonces, en ausencia de ingesta de proteínas, ¡el cuerpo se autocanibaliza y se autodigiere!
La ausencia de proteínas obliga al cuerpo a extraerlas de sus “reservas”: ¡la fusión de los músculos (incluido el corazón) y luego de las vísceras (intestino, hígado, etc.) es entonces inevitable!
Recurrir a las reservas provoca carencias: las defensas inmunitarias se debilitan, la digestión y el tránsito se ralentizan, la cicatrización es mala, la piel envejece...
Como suele ocurrir, las variaciones que se registran en el metabolismo proteico están muy ligadas al tipo de deporte practicado, y los problemas planteados serán muy diferentes según se trate de la disciplina deportiva de resistencia o de fuerza-potencia. Sin embargo, en la amplísima gama que va desde los ejercicios de corta y muy alta intensidad (ejercicio anaeróbico de tipo explosivo) hasta los ejercicios de larga duración de tipo duradero, las respuestas del metabolismo proteico son cualitativamente similares, asociando un descenso de la síntesis proteica y aumento de la degradación durante la actividad, y al revés durante la recuperación…
Recordatorios de lecciones de bioquímica...
Las proteínas constituyen una familia química heterogénea y se consideran biomoléculas de primera importancia:
- cuantitativamente, las proteínas representan del 55 al 85% del peso seco. Son el segundo elemento más común en el cuerpo después del agua.
- cualitativamente, tienen un papel estructural pero también un papel funcional vital.
Salvo casos excepcionales (ayunos prolongados, diabetes, etc.), las proteínas no contribuyen de forma significativa a cubrir las necesidades energéticas.
Tienen una función de sostén mecánico y soporte de los tejidos, por ejemplo el colágeno, la proteína más abundante en el organismo; a nivel celular, las proteínas del citoesqueleto (actina, tubulina) son responsables de la forma celular.
Tienen una función de catalizador bioquímico, caso de las enzimas sin las cuales casi todas las reacciones químicas serían imposibles en el organismo; papel de transportador de sangre, la albúmina (que es la proteína plasmática más importante, contribuye al transporte de ácidos grasos libres o de ciertas vitaminas) o la hemoglobina (situada en los glóbulos rojos, permite el transporte de oxígeno y dióxido de carbono); papel de transportador de membrana, las proteínas controlan cuantitativa y cualitativamente los intercambios entre la célula y el medio extracelular, los transportadores específicos de glucosa; papel de mediador químico como hormonas peptídicas como la insulina y el glucagón; papel del receptor de membrana; papel en el mantenimiento de la integridad del cuerpo, inmunoglobulinas (anticuerpos); función del movimiento, las proteínas contráctiles de los músculos (actina y miosina).
Las proteínas son compuestos orgánicos formados por carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N) a los que en ocasiones se les añade azufre (S). Su estructura monomérica es de aminoácidos. Dependiendo de la importancia de la polimerización y de la composición, es posible distinguir varios tipos de proteínas:
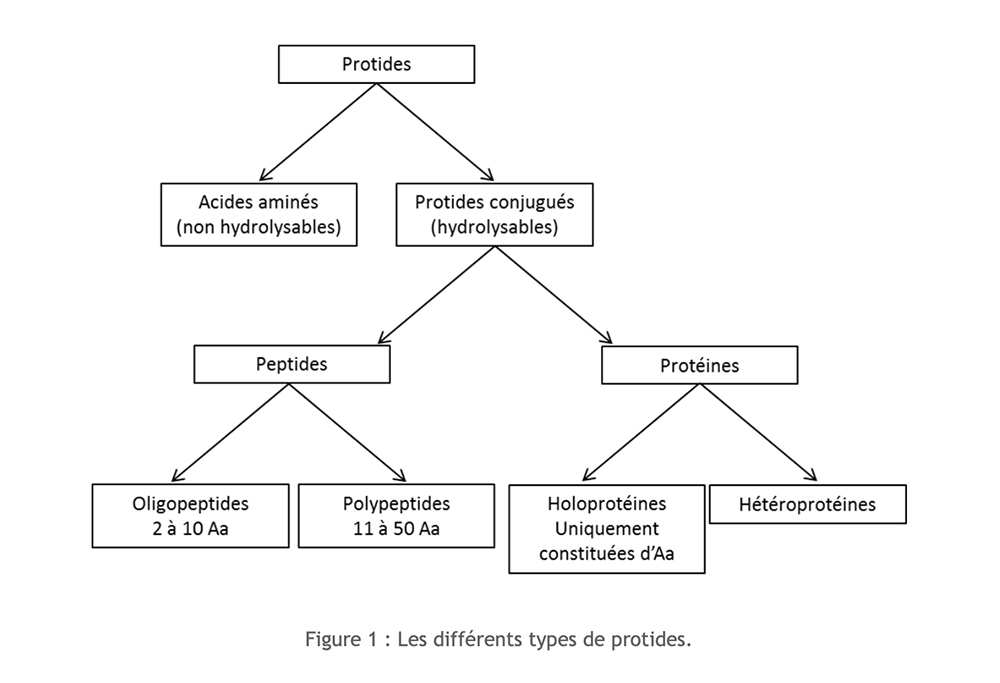
Aminoácidos
Los aminoácidos tienen una estructura molecular común. Son compuestos nitrogenados.
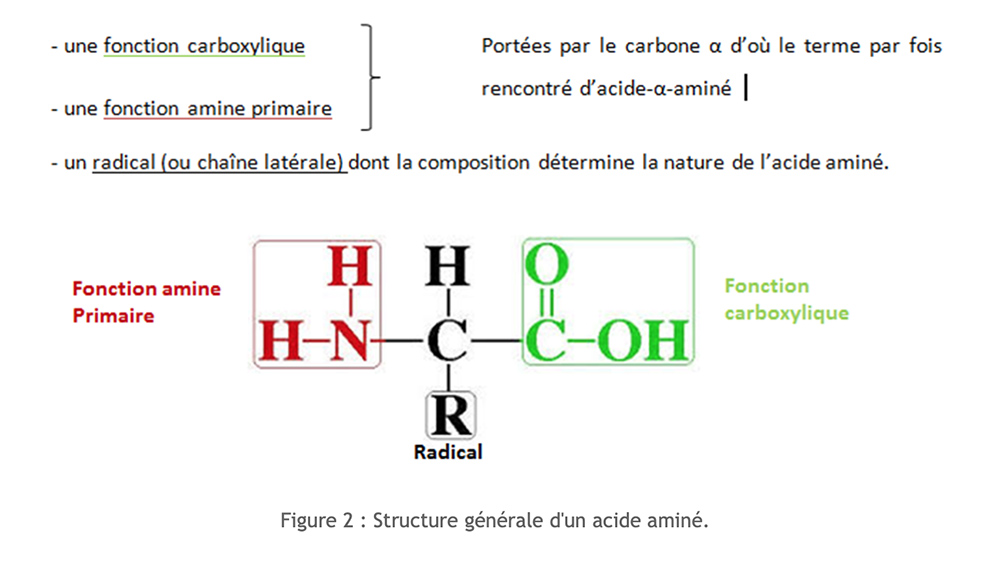
Se enumeran más de 250 aminoácidos diferentes. Sin embargo, todas nuestras proteínas están hechas de un grupo de 20 aminoácidos, que se denominanaminoácidos estándar.
Podemos clasificar estos aminoácidos según la naturaleza de su cadena lateral. Para facilitar la escritura de los aminoácidos se utiliza un código de tres letras o un código de una letra.
Los diferentes aminoácidos
Podemos enumerar ocho aminoácidos esenciales en adultos (Val, Leu, Ile, Thr, Met, Lys, Phe y Trp) más un noveno en niños (His). Estos aminoácidos deben estar imperativamente presentes en la dieta.
- glicina (Gly o G).
- alanina (Ala o A), aminoácido muy común en las proteínas.
- el valle (Val o V).
- leucina (Leu o L) y isoleucina (Ile o I) que el organismo no puede sintetizar, por lo que forman parte de los aminoácidos esenciales.
- serina (Ser o S).
- Treonina (Thr o T), que es un aminoácido esencial.
- cisteína (Cys o C) contribuye a la estabilización de la estructura terciaria de las proteínas gracias a la formación de puentes disulfuro. La cisteína también es la precursora de la taurina.
- metionina (Met o M) que forma parte de los aminoácidos esenciales.
- Ácido aspártico (Asp o D) y elácido glutamico (Glu o E). Estos aminoácidos son muy comunes en las proteínas. Como aminoácidos libres, juegan un papel importante en el metabolismo del nitrógeno. El ácido glutámico también sirve como precursor para la formación de ácido γ-aminobutírico (GABA), un mediador del sistema nervioso central.
- asparagina (Asn o N) y glutamina (Gln o Q); tienen un papel importante en el metabolismo del nitrógeno.
- lisina (Lys o K) es uno de los aminoácidos esenciales (se encuentra en particular en el colágeno).
- L'arginine (Arg o R) juega un papel importante en el ciclo de la urea y participa en la formación de creatina.
- histidina (His o H) se considera un aminoácido esencial en los niños.
- Fenilalanina (Phe o F) es uno de los aminoácidos esenciales. Como su nombre indica, su estructura es la de una alanina sustituida por un grupo fenilo, formando un radical hidrofóbico. Su hidroxilación da tirosina (Tyr o Y). Estos dos aminoácidos son importantes porque sirven como precursores para la biosíntesis de catecolaminas (siendo las más comunes la adrenalina, la noradrenalina y la dopamina). tirosina participa en la formación de hormonas tiroideas.
- triptófano (Trp o W) es un aminoácido esencial. Es un precursor biosintético de la serotonina y la vitamina B3.
- prolina (Pro o P). Al igual que la lisina, tiene la particularidad de estar hidroxilado dentro del colágeno: la hidroxiprolina.
Los péptidos
Los péptidos resultan de la asociación de aminoácidos. El enlace resulta de la condensación entre la función carboxílica (del carbono α) de un aminoácido y la función amina (del carbono α) de un segundo aminoácido. Esta condensación va acompañada de la liberación de una molécula de agua.
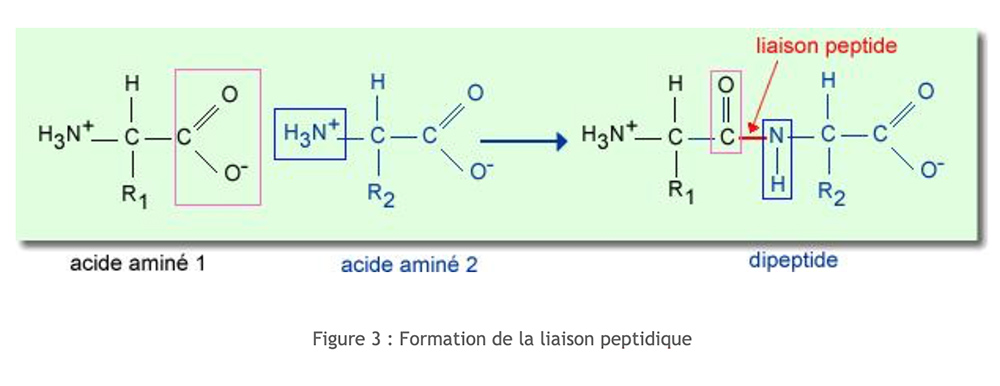
Esta disposición electrónica induce un enlace peptídico rígido y plano. Como resultado, no hay rotación entre C y N, lo que influye considerablemente en la estructura secundaria de péptidos y proteínas.
Ejemplos de péptidos de interés biológico
- Glutatión: Este tripéptido juega un papel importante a nivel celular al neutralizar los radicales libres, especialmente en los glóbulos rojos. Su secuencia es: γGlu-Cys-Gly.
- DHA: Este péptido es sintetizado por el hipotálamo a través de sus neuronas neurosecretoras. Liberado a nivel de la pituitaria posterior en la sangre, tiene un papel hormonal: estimula la reabsorción de agua por el riñón.
Ingesta de proteínas y ejercicio.
Hoy en día, se ha demostrado científicamente que el metabolismo de las proteínas se ve afectado por la práctica de ejercicio. Sin embargo, a menudo les damos demasiado protagonismo; La realidad nutricional es más mesurada.
La síntesis de proteínas es esencial para el desarrollo, el crecimiento, pero también para mantener la masa corporal. La práctica regular de deporte aumenta significativamente las necesidades diarias de compuestos nitrogenados y en particular en condiciones muy específicas (agotamiento de las reservas de glucógeno, caída brusca de azúcar en sangre, etc.). Sin embargo, no almacenamos aminoácidos. Si es necesario, por lo tanto, son los aminoácidos derivados de proteínas estructurales o funcionales los que se utilizarán, lo que probablemente afecte el funcionamiento del organismo.
Deportes de resistencia: oxidación de aminoácidos y requerimientos de proteínas
Si la necesidad de proteínas representa la cantidad óptima de proteínas necesarias para asegurar toda la síntesis proteica del organismo, para compensar la oxidación de aminoácidos y las pérdidas relativas debidas a la aceleración del recambio de proteínas, podemos concluir fácilmente que la repetición de ejercicios de resistencia induce un aumento en los requerimientos nutricionales de proteínas y aminoácidos. El ejercicio a largo plazo induce cambios significativos en el metabolismo de las proteínas. Estudios experimentales muestran que este tipo de práctica de resistencia se asocia con una reducción drástica de los procesos de síntesis de proteínas musculares. Por tanto, en el contexto de ejercicio prolongado, si el aporte de glucosa es insuficiente, se produce un aumento de la degradación proteica con el objetivo de aumentar la disponibilidad de aminoácidos que puedan contribuir a la gluconeogénesis o entrar en el ciclo de Krebs para aportar energía en el forma de ATP. Finalmente, el recuperación de este tipo de ejercicio requerirá considerar ingesta específica de proteínas.
Los aminoácidos disponibles en nuestro cuerpo tienen varios orígenes: se derivan de la ingesta dietética, resultan de la proteólisis endógena o se sintetizan de novo dentro del cuerpo (para los aminoácidos no esenciales). La disponibilidad de aminoácidos esenciales depende únicamente de la ingesta dietética y de su nivel de degradación.
Excluyendo el ejercicio, existe un equilibrio perfecto entre la degradación (proteólisis) y la síntesis de proteínas (proteosíntesis).
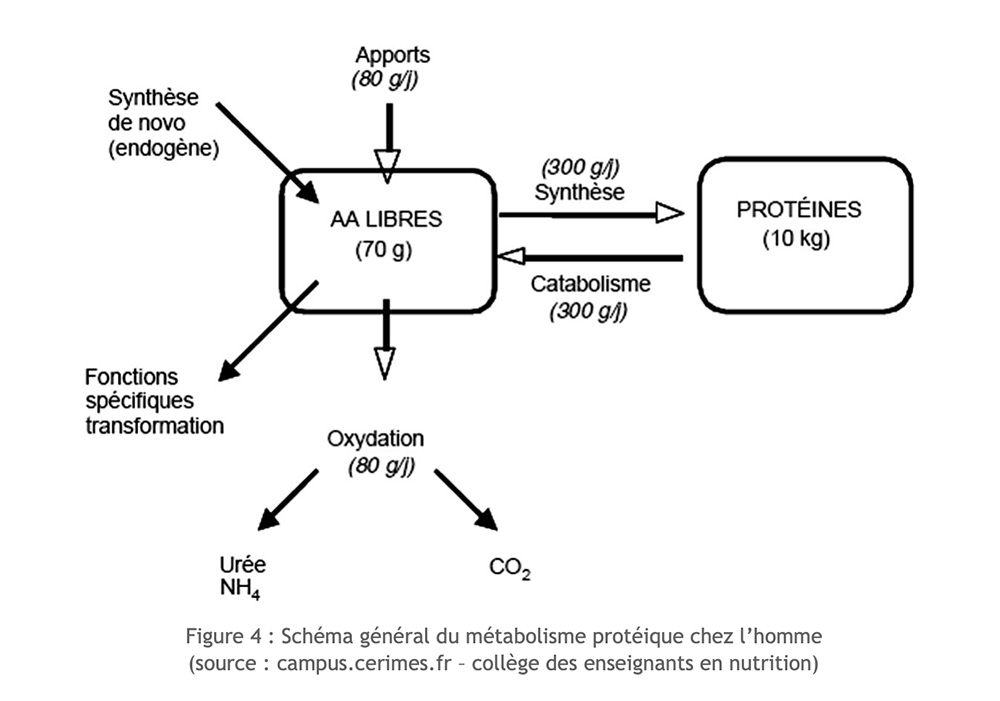
Pero en el contexto del ejercicio a largo plazo, la ingesta de nitrógeno se reduce, la síntesis de proteínas no puede compensar su degradación y la masa muscular se atrofia. Ciertos aminoácidos pueden entonces ser considerados como verdaderos sustratos útiles para el funcionamiento muscular. Se utilizan oxidativamente. Sin embargo, solo unos pocos aminoácidos pueden oxidarse directamente dentro del músculo esquelético: estos son esencialmente aminoácidos ramificados o ramificados (AAB: leucina, isoleucina, valina), y mucho más incidentalmente aspartato, asparagina y prolina.
Las proteínas en nuestra dieta
La proteína de los alimentos nunca entra directamente en nuestros tejidos. Debe ser "degradado" en aminoácidos o dipéptidos. Una vez que ha tenido lugar la fase de digestión, los aminoácidos ingeridos a través de nuestra ingesta de alimentos son indistinguibles de los resultantes de la degradación de las proteínas corporales. Para desarrollar sus propias proteínas, nuestro cuerpo tomará de la "bolsa común" donde se encuentran todos los aminoácidos disponibles (los provenientes de los alimentos y los resultantes de la destrucción de las proteínas corporales), en el tiempo "t". . En una situación ideal, nuestra ración debería proporcionar niveles óptimos de aminoácidos, en particular los ocho esenciales.
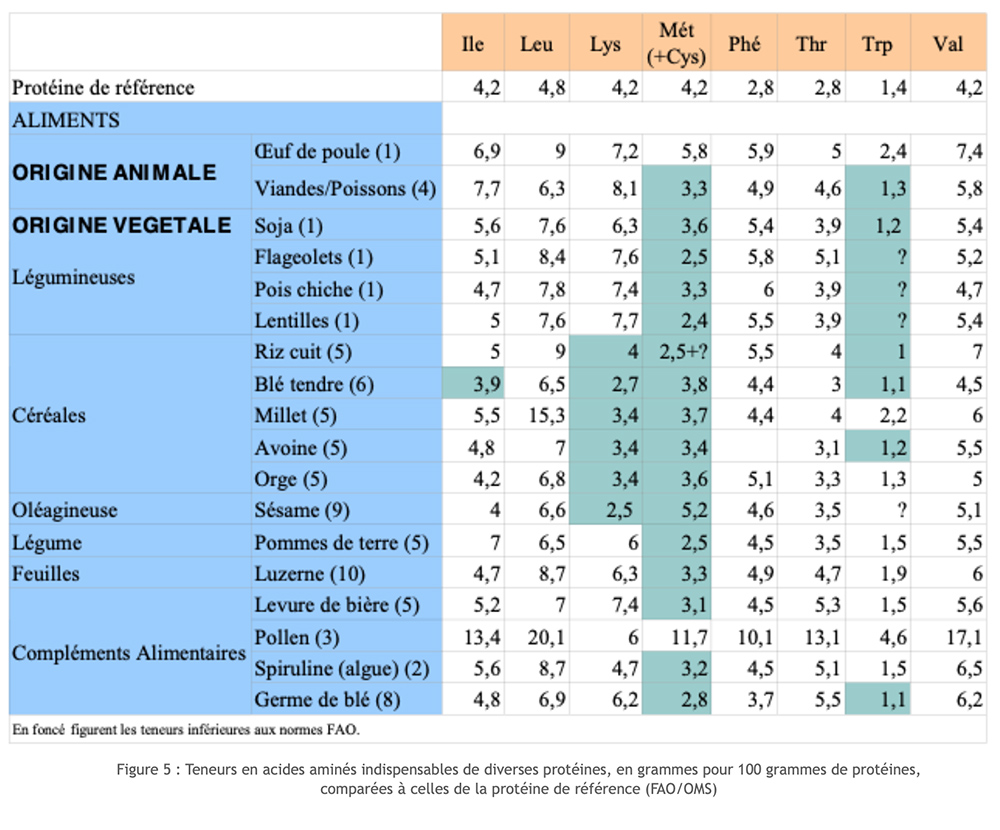
Las fuentes animales de proteína puntúan bastante bien en las escalas de Valor Biológico (BV) y Coeficiente de Utilización Digestiva (DUC). Esto es diferente para las proteínas vegetales. De hecho, ya se trate de cereales o legumbres, encontramos que algunos de los aminoácidos esenciales solo se proporcionan en niveles que son demasiado bajos (factor limitante). Los cereales generalmente carecen de lisina; las legumbres y la soja tienen el factor limitante metionina. Al unir las dos fuentes, logramos reconstituir un conjunto completo de AA esenciales, ¡pero con cierto derroche! Además, si esta elección permite prevenir carencias graves y crónicas de un AA esencial, no garantiza a largo plazo la correcta evolución de todos los metabolismos que implican la participación de aminoácidos. Esta insatisfacción funcional se encuentra en particular con la síntesis de neurotransmisores, particularmente la serotonina que depende del triptófano, aminoácidos que muy a menudo son limitantes.
A esto se suma el problema relacionado con los sistemas de captación de aminoácidos. Estos ingresan a las células a través de proteínas receptoras en las membranas celulares. Hay 4 familias de receptores para 20 aminoácidos. De hecho, se producen fenómenos de competencia. Por lo tanto, no es suficiente proporcionar un aminoácido en el nivel correcto para asegurarse de que los procesos resultantes se lleven a cabo correctamente. Los aminoácidos competidores no deben encontrarse a un ritmo demasiado elevado, lo que dificultaría la asimilación del primero.
La composición de aminoácidos crudos de una comida no nos permite deducir en qué medida el suministro de diferentes aminoácidos se proporcionará de manera óptima a cada una de nuestras células.
Cuando comes proteínas, incorporas nitrógeno a tu cuerpo. Cuando procedemos a la diferencia de los dos (entrada menos salida) obtenemos lo que se denomina el “balance de nitrógeno”. Se registra un balance de nitrógeno positivo cuando la ingesta de nitrógeno excede la suma de las excreciones urinarias, fecales y del sudor. Un balance de nitrógeno positivo es necesario para asegurar un nivel adecuado de síntesis. Es sobre este método de análisis que se definen las RNP (Recomendaciones nutricionales para la población), que se refieren a una noción esencialmente cuantitativa de las necesidades, y cumplen los objetivos de prevenir carencias y no afectar la síntesis proteica.
Las recomendaciones para los amantes de los deportes de resistencia son de consenso: 1,2 a 1,5 g/kg/día.
Así, para una persona de 70 kg de peso, la recomendación de ingesta de proteínas está entre: 84g/día a 105g/día; esto equivale, por ejemplo, a cantidades muy grandes de carne: ¡de 465 a 580 g! De ahí el interés de consumir otras fuentes de proteína (cereales, legumbres, etc.), o concentrados dirigidos a la recuperación temprana. Una vez más, se recomienda adoptar una dieta diaria variada y equilibrada, adaptada al nivel de entrenamiento.
En los deportistas, las necesidades relacionadas con la renovación funcional aumentan, en determinadas condiciones, debido al catabolismo de las proteínas, que afecta en particular a los elementos contráctiles del músculo (especialmente en los corredores, debido a la onda de choque que ejerce un efecto destructivo al repetirse mismo cada vez que el pie presiona el suelo). Estos procesos aumentan las pérdidas y se suman a las que corresponden al aprovechamiento energético de determinados aminoácidos. Como resultado, se puede observar una pérdida del nivel plasmático de la mayoría de los aminoácidos y un aumento en la excreción urinaria de nitrógeno después de una prueba de peatones de 100 km.
Pero tenga cuidado, el mayor uso de suplementos proteicos "no específicos" puede aumentar significativamente los requisitos; de hecho, la tasa de síntesis está fijada por la disponibilidad del aminoácido menos presente en los tejidos. Esto quiere decir que si los aminoácidos ramificados han visto disminuir su nivel en respuesta al ejercicio, las síntesis realizadas en el post esfuerzo serán proporcionales a las cantidades restantes de leucina, isoleucina y valina.
Ciertos aminoácidos actúan como moléculas capaces de estimular la síntesis de proteínas. La leucina es capaz de estimular específicamente la síntesis de proteínas en los músculos y el hígado, incluso en condiciones desfavorables (Cf.: Buse MG, Reid M (1975): Leucine, a possible regulator of protein deliver in muscle. J Clin. Invest., 58 : 1250).
La ingesta de suplementos proteicos ricos en aminoácidos ramificados permite, por tanto, evitar la atrofia muscular así como el deterioro de una serie de parámetros físicos, psíquicos y fisiológicos (Cf.: Degoutte F, Jouanel P & Coll (2006): Alimentación restricción y rendimiento, cambios bioquímicos, psicológicos y endocrinos en atletas de judo.Int. J. Sport Med., 27 (1): 9 – 18.).
Además de los aminoácidos ramificados, nos parecen otros dos que no se deben descuidar en la ración del deportista:
metionina (factor limitante para legumbres y soja):
La presencia de metionina (Met) en un nivel óptimo condiciona el desarrollo de un gran número de reacciones que también están condicionadas por el nivel de aporte energético. De hecho, como hemos visto anteriormente, Met puede contribuir a suministrar energía a los tejidos en una situación de emergencia. Esto se hace a través del ciclo de Krebs a expensas de otra intervención metabólica de Met. Por lo tanto, cualquier disminución en la ingesta dietética de Met conduce a una ralentización de estas diferentes vías, en particular la de la gluconeogénesis, y esto, con el fin de mantener su nivel mínimo en las células. Además, la transformación de Met en cisteína para promover la formación de glutatión (que participa en la cascada antirradicalaria), se ralentiza en favor del suministro de energía, o no puede tener lugar.
Glutamina, Glicina y Aspartato:
Nuestro capital energético se basa en la molécula de ADN que tiene forma de doble hélice (doble hebra). El ARN, por otro lado, es un polímero monocatenario similar al ADN. El ADN almacena información genética dentro de la célula, mientras que el ARN se utiliza para transmitir información de codificación fuera del núcleo celular y luego para sintetizar proteínas a partir de esta información. Las bases que componen el ARN son proporcionadas en pequeñas cantidades por los alimentos, la mayor parte en realidad proviene de síntesis llevadas a cabo en las células. Estos están hechos de aminoácidos, algunos de los cuales solo están disponibles en cantidades limitadas. Por lo tanto, el capital genético y las proteínas son estrechamente dependientes. Los precursores son: glutamina, glicina y aspartato. La glutamina está más involucrada ya que contiene 2 moléculas de nitrógeno. Por lo tanto, su disponibilidad es crucial en situaciones donde la rápida multiplicación celular es esencial (respuesta inmune, cicatrización, etc.). Aquí, la presencia de cofactores enzimáticos como el zinc, las vitaminas B9, B12 (solo de origen animal) y B6 resulta decisiva para el buen desarrollo del proceso de síntesis.
Por tanto, cualquier déficit o desequilibrio en la ingesta de estos aminoácidos, y en particular de la glutamina, afectará a la recuperación, la respuesta a la actividad.
Estos diferentes puntos hacen que sea muy complejo definir una ingesta proteica ideal/óptima. La recomendación, vista anteriormente, tiene en cuenta posibles trastornos funcionales para adecuar las capturas tanto cuantitativa como cualitativamente, sobre la diversidad. Los suplementos solo constituyen pequeños reajustes de la ración y consisten en péptidos altamente digeribles y específicos. En ningún caso deben compensar carencias nutricionales comprobadas. A veces considerados superfluos, parece sin embargo que van acompañados de una mejora en el estado de salud del atleta en cuestión.
Artículo escrito para nuestro socio Atlet por:
Caroline JOUCLA • Nutricionista-dietista certificada por el estado • www.carolinejoucladieteticienne.com
